Inicio de sesión
1 alerta activa
Mostrar

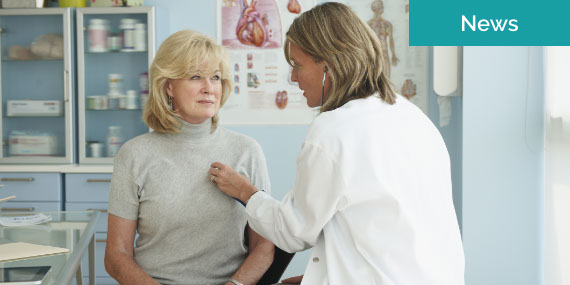
Nuestros proveedores son expertos en tratar y evitar enfermedades cardíacas, accidentes cerebrovasculares y otras enfermedades del corazón.
Aprenda como nuestros expertos en medicina generan salud hoy y dan los cuidados del mañana.
Mantener sus ojos sanos no solo protege su vista, sino que también puede prevenir problemas de salud graves en el futuro.
Las visitas por video y por teléfono ahora están disponibles para todos los consultorios de atención primaria y pediátrica, y para todos los proveedores.
ChristianaCare ofrece servicios de laboratorio para pacientes ambulatorios en ubicaciones de los condados de New Castle y Kent.
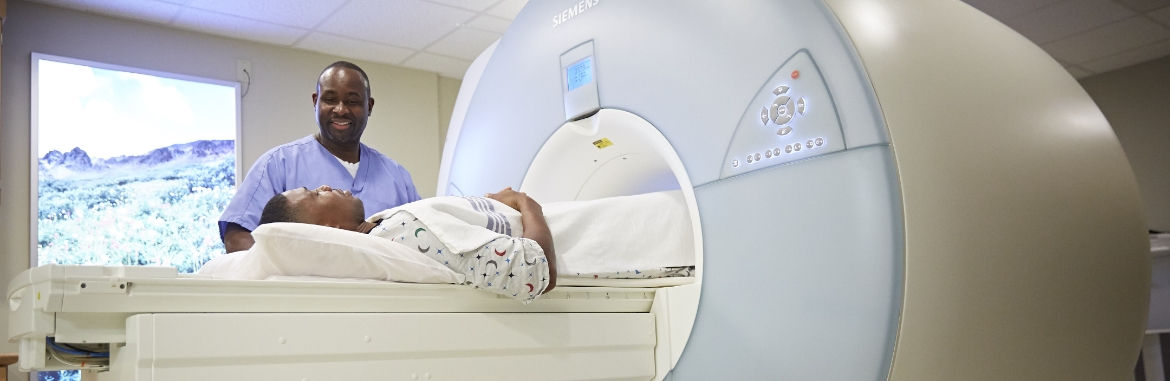
Con 16 ubicaciones acreditadas y de fácil acceso en todo el condado de New Castle, el acceso a los estudios de diagnóstico radiológico más avanzados de la actualidad nunca ha sido más fácil.
Los portales para pacientes de ChristianaCare le ayudan a crear un sitio personal y seguro que le permite controlar su salud.
Nuevos centros de atención de urgencia con un cómodo horario fijo de noche, día, fin de semana y feriados, los 365 días del año.
ChristianaCare consta de tres hospitales, con más de 1,200 camas, y servicios para pacientes ambulatorios y otros en todo el norte de Delaware y las áreas circundantes.
Historias más recientes de ChristianaCare
Descubra las noticias más recientes de ChristianaCare, así como historias de pacientes y cuidadores.
Descubra historias de pacientes y noticias de ChristianaCare relacionadas con atención primaria.